Assises internationales envirobio 13-14/11/2000 Paris
Gestion des risques.
Santé et environnement : le cas des nitrates
Phosphore, azote et prolifération des végétaux aquatiques
http://www.inra.fr/dpenv/barroc48.htm
par Guy Barroin
INRA - Hydrobiologie et faune sauvage, BP 511, 74203 Thonon-les-Bains
barroin@thonon.inra.fr
Résumé
Introduction
Végétaux aquatiques et nutrition minérale
Evolution du peuplement algal
Evolution du réseau trophique
Conséquences pour l'homme
Sensibilité locale et pollution globale
Le milieu marin
Moyens de lutte
Utilité du nitrate
A qui la faute ?
Conclusion
Le Courrier n°48 a publié une version raccourcie de ce texte.
C'est à partir des substances minérales dissoutes dans l'eau que les algues synthétisent leurs tissus. Du point de vue de la structure, le carbone est le composant principal, après l'hydrogène et l'oxygène. Mais c'est le phosphore qui, en conditions naturelles, est le tout premier nutriment à faire défaut pour assurer la synthèse de nouveaux tissus, avant l'azote et le carbone. Le phosphore est dit " facteur limitant ", notion empruntée à l'agronomie. C'est également le facteur de maitrise puisque c'est en agissant sur lui qu'il est possible d'augmenter ou de réduire les proliférations algales.
En déversant dans le réseau hydrographique des quantités considérables de phosphore, les activités humaines, qu'elles soient domestiques, industrielles ou agricoles, induisent une carence en azote. Cette situation stimule la prolifération de cyanobactéries capables de fixer l'azote moléculaire dont l'atmosphère constitue une réserve quasi inépuisable. Une fois métabolisé cet azote se retrouve dans le milieu aquatique et participe à son fonctionnement au même titre que les apports anthropiques. D'autres espèces cyanobactériennes peuvent se développer en raison de leur aptitude à proliférer dans les conditions d'éclairement réduit qu'entraîne la prolifération des algues, toutes espèces confondues.
Mise en évidence à l'échelle réduite de temps et d'espace propre à l'expérimentation scientifique la carence en azote fait apparaître ce dernier comme facteur limitant, ce qui occulte le fait qu'à l'échelle globale de l'hydrosystème c'est le phosphore qui est le facteur limitant puisque c'est lui qui déclenche la fixation biologique de l'azote.
Outre leurs remarquables facultés d'adaptation, les cyanobactéries ont une taille, une consistance et une toxicité qui empêchent les prédateurs potentiels (zooplancton herbivore) de les consommer. Elles finissent donc par dominer le peuplement algal modifiant le fonctionnement du réseau trophique au point de nuire aux divers usages attendus de l'eau. Le développement de conditions anoxiques dans la masse d'eau entraîne l'élimination de toutes les formes supérieures de la vie, à commencer par les poissons de qualité (salmonidés). A l'interface eau/sédiment l'anoxie entraîne la réduction des composés du fer et le relargage du phosphore qu'ils piégeaient lequel vient s'ajouter aux apports du bassin versant pour intensifier le processus de dégradation. La présence de cyanobactéries pose des problèmes spécifiques en relation avec les toxines qu'elles sécrètent.
Cette implacable évolution en réponse à la pollution par les phosphates se manifeste d'autant plus intensément que le caractère stagnant des eaux est prononcé. Il ne faudrait cependant pas utiliser cette influence primordiale de la stagnation du milieu pour réserver un traitement préférentiel à des zones dites " sensibles ", abandonnant le reste du territoire à une pratique de la déphosphatation à l'économie. En effet, l'extrème solidarité du réseau hydrographique fait que de telles mesures discriminatoires ne peuvent qu'engendrer la généralisation de la dégradation des eaux stagnantes ou ralenties selon un gradient amont/aval, l'aval ultime étant la mer.
Lutter contre le nitrate pour résoudre le
problème de l'eutrophisation est une solution à la fois pratiquement impossible
car il faudrait rendre l'azote plus limitant que le phosphore au voisinage des
concentrations naturelles, celles d'une eau de qualité, écologiquement
dangereuse car elle stimule les proliférations cyanobactériennes, techniquement
inefficace du fait de la réinjection automatique par les cyanobactéries de
l'azote que l'on s'efforce d'éliminer et rationnellement douteuse : ne
propose-t'on pas de traquer le nitrate pour lutter contre la pollution par les
phosphates ?
Non seulement le nitrate n'est pas la bonne cible mais sa présence contribue à
traiter deux conséquences néfastes de la pollution par les phosphates : son
azote augmente le rapport N/P et empêche l'apparition des fixatrices d'azote,
son oxygène entretient l'oxydation des composés du fer à l'interface
eau/sédiment et empêche le relargage du phosphore associé.
Pour mener à bien la gestion de l'environnement, les
autorités mandatées doivent se conformer aux textes officiels, ceux publiés par
la CEE constituant la référence. Dans sa Directive du 21/05/1991 relative au
traitement des eaux urbaines résiduaires la Commission définissait l'"
eutrophisation " comme " l'enrichissement de l'eau en éléments nutritifs,
notamment des composés de l'azote et/ou du phosphore, provoquant un
développement accéléré des algues et des végétaux d'espèces supérieures qui
perturbe l'équilibre des organismes présents dans l'eau et entraîne une
dégradation de la qualité de l'eau en question " cette définition relevant
d'" Actes dont la publication n'est pas une condition de leur applicabilité ".
Quelques mois plus tard, dans sa Directive du 12/12/1991 concernant la
protection des eaux contre la pollution par les nitrates à partir de sources
agricoles, la Commission définissait l'" eutrophisation " comme "
l'enrichissement de l'eau en composés azotés, provoquant… " cette
définition relevant alors d'" Actes dont la publication est une condition de
leur applicabilité ".
En comparant ces deux définitions le lecteur s'étonnera sans doute de voir
disparaître le phosphore comme facteur causal. Il mettra cette disparition sur
le compte des progrès décisifs réalisés par la science dans le semestre séparant
la publication des deux définitions à moins qu'il n'y voie le fruit d'une
divergence d'opinion entre experts de domaines distincts, " Traitement des eaux
urbaines résiduaires ", d'une part ,et " Protection des eaux contre la pollution
par les nitrates à partir de sources agricoles " ,d'autre part. Quoiqu'il en
soit, la question reste de savoir lequel de " l'azote et/ou du phosphore
" il convient de traquer pour maîtriser le " développement accéléré des
algues et des végétaux d'espèces supérieures… ".
Les lignes qui suivent ont pour but d'apporter une réponse à cette question en
commençant par décrire ce que sont ces végétaux aquatiques et la façon dont ils
utilisent les substances minérales pour se développer au point de " [perturber]
l'équilibre des organismes présents dans l'eau et [d'entraîner] une
dégradation de la qualité de l'eau en question. "
[R] Végétaux aquatiques et nutrition minérale
Dans la pratique on distingue deux grandes catégories d'organismes végétaux : les algues et les plantes aquatiques.
Les algues. Qu'elles soient fixées ou qu'elles
flottent librement dans l'eau (phytoplancton), les algues se distinguent des
végétaux supérieurs par l'absence de tissus différenciés, c'est-à-dire qu'elles
ne possèdent ni racines, ni tiges, ni feuilles. Invisibles à l'œil nu à l'état
unicellulaire, d'où leur nom de microphytes, elles peuvent se présenter groupées
en colonies ou assemblées en filaments. Le phytoplancton donne à l'eau une
couleur qui peut aller du vert au rouge en passant par le brun plus ou moins
foncé. Dans certaines conditions la population algale croît de façon brutale,
quasi explosive : c'est la fleur d'eau, le " bloom " des anglo-saxons. Résultant
d'une intense multiplication végétative des cellules, la fleur d'eau peut se
manifester en surface sous forme d'une couche crémeuse, voire gélatineuse,
rougeâtre ou vert-bleuâtre dans le cas d'espèces particulières (cyanobactéries,
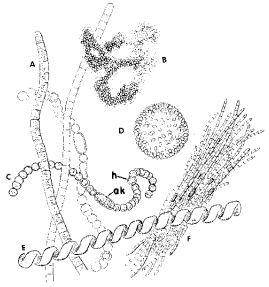
fig. 1).
Une autre manifestation macroscopique de ces organismes végétaux sont les algues
filamenteuses. Démarrant leur multiplication à partir d'un quelconque point
d'ancrage, elles envahissent la colonne d'eau et finissent en surface, portées
par les bulles d'oxygène qu'elles produisent et qui restent coincées dans leurs
réseaux de filaments pour former ce que le public appelle improprement des "
mousses ". La production nette des algues est fonction de la lumière disponible,
des nutriments biodisponibles dans l'eau, du temps de séjour, de l'activité
consommatrice des organismes et, dans une moindre mesure, de la température,
laquelle influence surtout l'activité animale.

A)- Planktothrix (anciennement Oscillatoria)
B)- Microcystis aeruginosa
C)- Anabaena flos-aquae avec une akinète (ak) et un hétérocyste
(h)
D)- Coelosphaerium
E)- Spirulina
F)- Aphanizomenon flos-aquae
Fig. 1 : Quelques cyanobactéries représentatives des lacs et des marais (d'après Haynes, 1988)
Les plantes aquatiques. Egalement appelées macrophytes
du fait qu'elles sont visibles à l'œil nu, elles comprennent pour l'essentiel
des végétaux supérieurs qui, munis de racines de tiges et de feuilles, portent
des fleurs, produisent des graines (angiospermes) et se développent en herbiers.
Dans certains habitats on peut trouver également en abondance des fougères
aquatiques, des mousses et même des algues de grande taille du groupe des
charophycées. Pratiquement, on distingue les plantes qui flottent librement en
pleine eau de celles qui sont fixées au fond, ces dernières se subdivisant à
leur tour en plantes émergées (jusqu'à 1,5 m d'eau), plantes à feuilles
flottantes (jusqu'à 3 m d'eau) et plantes immergées (dans toute la couche
euphotique, les angiospermes s'arrêtant à 10 m de profondeur). Les macrophytes
flottants dépendent pour leur nutrition des éléments biodisponibles dans l'eau,
comme le phytoplancton, alors que les macrophytes fixés puisent l'essentiel de
leurs nutriments dans les sédiments. Par ailleurs, et comme pour tout organisme
végétal, leur production dépend de la lumière disponible, les macrophytes fixés
étant limités dans leur croissance par la pénétration de celle-ci et par la
longueur des tiges pour ceux qui en possèdent. Elle dépend également de la
consommation par les herbivores et, dans une moindre mesure, de la température.
La nutrition minérale. En supposant favorables la lumière, la
température, l'hydrodynamique et toutes les autres conditions environnementales,
c'est la biodisponibilité des nutriments présents dans l'eau, gaz et minéraux en
solution, qui commande la prolifération des végétaux strictement aquatiques
(microalgues, macroalgues et macrophytes flottants). La demande exercée par
ceux-ci est fonction de la composition de leurs tissus vivants. La composition
moyenne du végétal aquatique, algues et plantes aquatiques enracinées
confondues, fait apparaître le carbone comme constituant majeur, mis à part bien
entendu l'oxygène et l'hydrogène (Tab. 1). Vient ensuite le silicium, peu
abondant chez les végétaux terrestres mais omniprésent dans le monde aquatique
au travers des diatomées, riche classe d'algues dont le protoplasme est contenu
dans un exo-squelette siliceux. L'azote est l'élément suivant, précédent le
calcium, le potassium et le phosphore qui, avec ses 0,08 %, n'a guère plus
d'importance que le magnésium, le soufre ou le chlore.
Eléments |
SYMBOLE |
Demande (végétal) % |
offre (eau) % |
dem/offre (approx) |
| Oxygène Hydrogène Carbone Silicium Azote Calcium Potassium Phosphore Magnésium Soufre Chlore Sodium Fer Bore Manganèse Zinc Cuivre Molybdène Cobalt |
O H C Si N Ca K P Mg S Cl Na Fe B Mn Zn Cu Mo Co |
80,5 9,7 6,5 1,3 0,7 0,4 0,3 0,08 0,07 0,06 0,06 0,04 0,02 0,001 0,0007 0,0003 0,0001 0,00005 0,000002 |
89 11 0,0012 0,00065 0,000023 0,0015 0,00023 0,000001 0,0004 0,0004 0,0008 0,0006 0,00007 0,00001 0,0000015 0,000001 0,000001 0,0000003 0,000000005 |
1 1 5.000 2.000 30.000 <1.000 1.300 80.000 <1.000 <1.000 <1.000 <1.000 <1.000 <1.000 <1.000 <1.000 <1.000 <1.000 <1.000 |
Tableau 1 - Concentration des éléments dans le végétal
(demande), dans une eau naturelle (offre) et rapport demande/offre. Avec
80.000, le phosphore a le rapport le plus élevé, c'est à dire la demande la
moins bien satisfaite, viennent ensuite l'azote (D/O = 30.000), puis le carbone
(D/O = 5.000) (Vallentyne, 1974).
Que du point de vue de la composition tissulaire le carbone
soit l'élément principal ne signifie pas que la prolifération algale dépende de
sa biodisponibilité. En effet la demande algale étant satisfaite en puisant dans
une eau où les éléments sont présents à des concentrations différentes de celles
de cette composition tissulaire, c'est l'élément pour lequel la demande est la
plus forte par rapport à l'offre qui va limiter la synthèse de nouveaux tissus.
En considérant la composition moyenne d'une eau naturelle, et en établissant
pour chaque élément le rapport [Demande/Offre], on constate qu'avec un rapport
de 80 000 le phosphore vient en tête, devançant l'azote (30 000) et le carbone
(5 000) (Tab. 1). Le phosphore est dit " facteur limitant ", concept emprunté à
l'agronomie, l'ordre d'importance des éléments en termes de facteur limitant,
P-N-C, étant très exactement l'inverse de ce qu'il est en termes de composition
tissulaire, C-N-P. Qu'en conditions naturelles le phosphore soit facteur
limitant signifie qu'il faut en augmenter la quantité biodisponible pour
augmenter la quantité d'algues produites, ce qui correspond à l'application
agronomique du concept. Mais cela signifie également qu'il faut en réduire la
quantité biodisponible pour réduire la quantité d'algues produites, type
d'intervention étrangère à la pensée agronomique. En résumé, en conditions
naturelles le phosphore est le facteur limitant de l'augmentation de la
prolifération algale, il est également le facteur de maîtrise de son
augmentation autant que de sa réduction.
Si l'on s'en tient au tableau 1, le rapport N/P dans le végétal aquatique est de
0,7/0,08 = 8,75. Ceci signifie qu'un milieu nutritif possédant un rapport N/P
égal à cette valeur est parfaitement équilibré par rapport aux besoins du
végétal moyen. Si son rapport est inférieur à 8,75 il présente un déficit
d'azote par rapport au phosphore : l'azote y est le facteur limitant. Si son
rapport est supérieur à 8,75, il présente un déficit de phosphore par rapport à
l'azote : le phosphore y est le facteur limitant. En fait, la composition du
végétal aquatique varie selon les espèces et selon les conditions de milieu,
notamment les conditions nutritives : si l'élément est en excès il y a "
consommation de luxe ", ce qui permet de constituer des réserves, si l'élément
vient à manquer la concentration cellulaire tombe au " quota minimal de
subsistance " en dessous duquel la croissance est impossible. La frontière entre
les deux domaines de carence n'est donc pas précise et correspond plus à un " no
man's land " compris entre 7 et 10 qu'à une ligne de démarcation située à 8,75 :
l'azote ou le phosphore est facteur limitant dans un milieu nutritif selon que
N/P y est <7 ou >10.
[R] Evolution du peuplement algal
Le phosphore doit son statut d'élément clef du métabolisme
cellulaire à certaines caractéristiques de rareté qui le distinguent
fondamentalement de l'azote et du carbone. Quasi inexistant à l'état gazeux, il
est naturellement fort peu abondant en milieu aquatique pour deux raisons. D'une
part sa source, strictement géologique, est elle-même peu abondante, 0,1 % dans
les sols en moyenne pour atteindre 15 % dans les mines, et d'autre part, au
cours de son cheminement au travers de l'écosystème terrestre, il est fortement
fixé par les constituants majeurs des sols que sont les composés du fer, de
l'aluminium et du calcium et avidement prélevé par les plantes terrestres. Par
contre, l'azote et le carbone disposent dans l'atmosphère d'une source
quasi-inépuisable (N2, CO2) dans laquelle ils sont
prélevés dès qu'ils font défaut par rapport au potentiel permis par le
phosphore. Les processus biologiques de prélèvement sont, respectivement, la
fixation de l'azote et la photosynthèse, alors que le retour à l'atmosphère est
assuré par la dénitrification et la respiration.
Le déversement de quantités croissantes de phosphore finit par lui faire perdre
son statut de facteur limitant au profit de l'azote, ce qui a lieu, on l'a vu,
pour un rapport N/P <7. La carence relative en azote provoque immédiatement la
prolifération d'organismes capables de fixer l'azote moléculaire (N2)
dissous dans l'eau. La première étape de cette fixation consiste en une
réduction à l'état d'ammoniac (NH3) qui est un mécanisme strictement
anaérobie. En pleine eau, il est réalisé par des algues possédant des
hétérocystes qui sont des cellules dépourvues du photosystème II générateur
d'oxygène. Ces algues sont des cyanobactéries hétérocystées, essentiellement des
genres Anabaena et Aphanizomenon. Une fois réduit en ammoniac
l'azote suit la voie normale de l'assimilation qui le transforme en azote
organique cellulaire pour subir ultérieurement, à l'échelle de l'écosystème, les
processus normaux de minéralisation pour en faire de l'azote ammoniacal
éventuellement oxydé en azote nitrique.
La fixation de l'azote moléculaire n'est pas réservée aux algues de pleine eau,
elle peut également avoir lieu dans les milieux où la vitesse du courant empêche
toute prolifération phytoplanctonique. Nostoc est une algue fixatrice
d'azote qui pousse sur les substrats rocheux et dont la présence est commune
dans les cours d'eau du monde entier, même rapides, et ce jusqu'à 2000 mètres
d'altitude. En conditions anoxiques, d'autres organismes procaryotiques sont mis
à contribution pour fixer l'azote moléculaire (bactéries photosynthétiques,
bactéries hétérotrophes). Il faut enfin signaler les rapports de proximité
qu'entretiennent certains de ces procaryotes avec les plantes aquatiques
supérieures auxquelles ils apportent l'azote manquant. Il peut s'agir des algues
et des bactéries symbiotiques qui pullulent dans la rhizosphère de Lemna,
mais aussi d'Anabaena azollae qui, associée à Azolla, lui confère
une richesse azotée mise à profit pendant des siècles pour fertiliser les
rizières et nourrir le bétail. Finalement, cet azote moléculaire d'origine
atmosphérique participe au fonctionnement de l'écosystème au même titre que les
autres apports du bassin versant, qu'ils soient organiques ou minéraux,
d'origine naturelle ou anthropique, et participe au même titre qu'eux à tous les
processus biogéochimiques impliquant l'azote, son inertie chimique originelle
ayant été " activée " par les apports de phosphore via les organismes
fixateurs d'azote.
Si le déversement de quantités croissantes de phosphore dans le milieu aquatique
a pour effet de modifier le peuplement algal en faveur des cyanobactéries
fixatrices d'azote pour cause de carence relative en azote, il a également pour
effet de stimuler la prolifération algale, toutes espèces confondues, et de
diminuer la transparence de l'eau. L'intensification de cet auto-ombrage (self
shading en anglais) s'accompagne d'une évolution des espèces algales, les
plus exigeantes en matière d'éclairement cédant la place aux moins exigeantes
qui appartiennent, là aussi, à la classe des cyanobactéries (fig. 2).
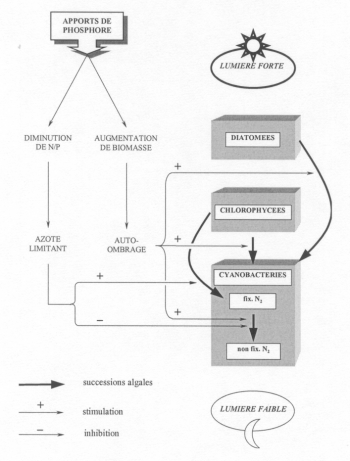
Fig. 2 : Successions algales induites par un enrichissement en phosphore. (d'après Zevenboom et Mur, 1980)
En effet, pour pratiquer la photosynthèse ces dernières
possèdent des pigments accessoires, les phycobiliprotéines (= phycobilines), en
plus de la chlorophylle a et des caroténoïdes qui, eux, sont des pigments
communs à toutes les algues. Capables d'utiliser les régions du spectre lumineux
comprises entre les pics d'absorption de la chlorophylle a et des
caroténoïdes, ces phycobilines ont deux composantes principales, la phycocyanine
et la phycoérythrine, dont la synthèse est réalisée selon un rapport déterminé
par la qualité de la lumière. Cette remarquable adaptation chromatique jointe à
de très faibles besoins énergétiques pour maintenir la structure et assurer le
fonctionnement des cellules permet aux cyanobactéries d'utiliser au mieux leur
environnement lumineux ce qui représente une redoutable supériorité par rapport
aux autres algues, même lorsque la dégradation des conditions lumineuses a
d'autres causes que l'auto-ombrage : coloration naturelle, remise en suspension
des sédiments, affluents chargés de matières en suspension…Finalement la masse
d'eau se trouve envahie par des cyanobactéries, qu'elles soient fixatrices
d'azote ou non dépendant de ce qui manque le plus de l'azote ou de la lumière
La physiologie des cyanobactéries possède bien d'autres particularités. Leur
vitesse de croissance est beaucoup plus faible que celle des autres espèces
algales et elle est maximale pour des températures supérieures à 25°C. Elles ne
produisent donc des fleurs d'eau que dans des milieux fortement stagnants et
durant l'été (zone tempérée ou boréale), conditions propices aux pH élevés
qu'elles affectionnent particulièrement. Réputées proliférer dans les lacs
eutrophes et hypereutrophes, les affinités qu'elles ont pour le phosphore et
l'azote, bien supérieures à celles des autres algues, jointes à
d'exceptionnelles capacités de stockage vis à vis du phosphore leur permet de
dominer le peuplement algal quand des mesures sont prises pour rétablir des
conditions oligotrophes…dans l'espoir de les voir disparaître.
Une autre particularité, et non des moindres, est la présence de vacuoles
gazeuses qui permet à la plupart des cyanobactéries de se positionner à la
profondeur où elles rencontrent les conditions de vie qui leur sont les plus
favorables. L'efficacité de ce moyen actif de régulation de la flottaison est
augmentée par la grande taille des cellules et leur agglutination dans une sorte
de gel protecteur. Le positionnement dans la colonne d'eau peut être piloté par
des besoins d'éclairement ou de nutrition. Enfin, en présence de conditions
environnementales particulièrement défavorables, certaines cyanobactéries
filamenteuses développent des cellules de résistance spécifiques, les akinètes,
que même les bactéries ne possèdent pas. Complètement enfermées dans une épaisse
enveloppe de protection et munies d'importantes réserves d'hydrates de carbone,
les akinètes tombent sur le fond, peuvent résister aux pires conditions de gel
ou de sécheresse et, comme des graines, redonnent de nouveaux filaments quand
les conditions sont à nouveau favorables. Les akinètes offrent également un
excellent conditionnement pour le transport aérien d'un plan d'eau à un autre
par la faune aviaire.
Si les cyanobactéries ont un comportement tout à fait exceptionnel par rapport
aux conditions environnementales auxquelles elles doivent faire face, tout aussi
exceptionnelle apparaît leur capacité à échapper à la prédation. En effet, alors
que les algues planctoniques sont broutées par les protozoaires et le
zooplancton crustacé, cladocères et copépodes, les cyanobactéries échappent à ce
broutage. En effet, seuls quelques ciliés et quelques rhizopodes sont capables
de les consommer, sans grande efficacité d'ailleurs. Ce déficit de prédation
tient à trois de leurs caractéristiques essentielles : la grande taille des
cellules ou leur agglutination sous forme coloniale quand elles sont de petite
taille, leur protection par une enveloppe gélatineuse et leur aptitude à
sécréter des toxines. En fait, leur élimination est surtout due à leur
destruction par les virus, les bactéries et les champignons. N'ayant que peu
d'ennemis réellement efficaces et douées d'exceptionnelles facultés de
flottaison qui les soustraient à la sédimentation, leur vitesse d'élimination
est très faible ce qui compense largement leur faible vitesse de croissance pour
assurer leur permanence dans le milieu une fois qu'elles y ont été installées
par un excès de phosphore.
[R] Evolution du réseau trophique
La prolifération luxuriante du phytoplancton et la domination
du peuplement algal par les cyanobactéries résultant des apports immodérés de
phosphore ne sont pas sans influencer les autres composants de l'écosystème
aquatique. En plus de la quasi-élimination des autres espèces algales elles
conduisent également à la disparition des plantes aquatiques, la turbidité de
l'eau finissant par empêcher les jeunes plantules de disposer de la lumière
nécessaire à leur croissance. La consommation d'oxygène que provoque la
respiration d'une importante biomasse algale ainsi que la minéralisation de la
matière organique qu'elle représente, à laquelle s'ajoute la pollution organique
issue du bassin versant, finit par créer des conditions anoxiques dont les
salmonidés (omble chevalier, truite…) sont les premières victimes. Réputés
exigeants en oxygène ces poissons sont d'abord touchés au niveau de la
reproduction du fait de l'envasement de leurs frayères et de la nutrition en
raison de la raréfaction de la faune benthique dont ils se nourrissent. Mais
même les cyprinidés (gardon, tanche…), particulièrement résistants, finissent
par disparaître car ils ne peuvent pas supporter les intenses épisodes de
désoxygénation nocturne dus à ce qu'en l'absence de photosynthèse, l'oxygène
consommé par la respiration algale n'est pas renouvelé.
Si la désoxygénation a pour effet sur la biologie d'éliminer les formes
supérieures de la vie, elle a pour effet sur la chimie de faire décrire une
succession de réductions dont les conséquences ne sont guère plus heureuses et
dont l'ordre, immuable, est dicté par les caractéristiques chimiques des
substances mises en jeu (fig.3).
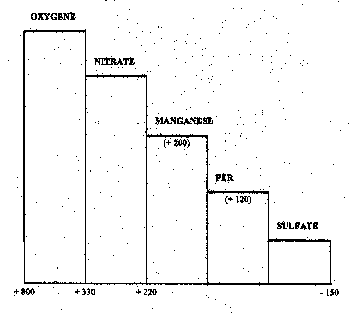
Fig. 3 : Réduction séquentielle des agents oxydants. Les nombres figurant à la base de la figure représentent le potentiel redox approximatif (mV) à partir duquel le constituant précédent devient indétectable en solution. Les nombres entre parenthèses représentent le potentiel redox approximatif (mV) à partir duquel la forme réduite du constituant devient détectable en solution (d'après Gunnison et al., 1985).
Le nitrate est le premier à céder son oxygène
(dénitrification) libérant essentiellement de l'azote qui finit par être
restitué à l'atmosphère. Dans des conditions voisines de désoxygénation se
produit la réduction des composés oxydés du manganèse (manganiques) à l'état
manganeux beaucoup plus soluble. La poursuite de la désoxygénation entraîne la
réduction des composés oxydés du fer (ferriques) à l'état ferreux lui aussi
beaucoup plus soluble, d'où le relargage du phosphore fortement fixé par les
composés ferriques. Intervient ensuite la réduction des sulfates en sulfures qui
se lient au fer pour donner du sulfure de fer, composé particulièrement stable.
Le fer ainsi immobilisé ne peut plus participer à la fixation du phosphore. Ces
sulfures peuvent également être présents sous forme de sulfure d'hydrogène, gaz
toxique à odeur d'œuf pourri caractéristique. Cette cascade de réductions
s'achève par les processus de fermentation qui attaquent les substances
carbonées pour donner du méthane.
Les phénomènes d'oxydoréduction ont une importance toute particulière à
l'interface eau/sédiment, frontière entre deux milieux où les concentrations
sont fort différentes. La réduction de cette interface a pour effet de provoquer
le relargage de bon nombre de substances gênantes, voire toxiques, et d'en
enrichir l'eau surnageante. Ce relargage tient son efficacité de la plus grande
solubilité des formes réduites mais aussi de la formation de bulles lorsque les
gaz produits dépassent la saturation. A l'inverse, l'oxydation de l'interface y
maintient précipitées ces substances, le seul mode de transfert réellement
efficace étant alors la bioturbation. Cette oxydation est, bien entendu, le
résultat de la présence d'oxygène mais également, comme il vient d'être exposé,
de nitrate qui bloque la cascade de réductions, empêchant notamment la réduction
des composés ferriques et le relargage du phosphore associé.
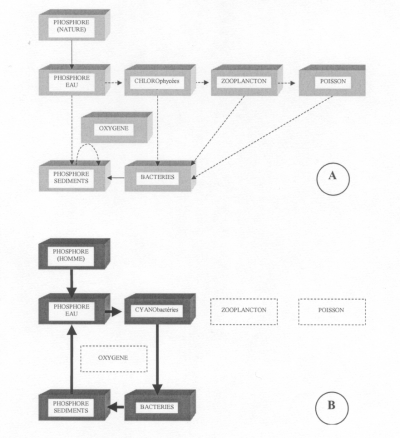
Fig. 4 : Effets d'un apport de phosphore dans une eau stagnante. (A) : apport faible, voisin du naturel, conduisant à une chaîne alimentaire complète. (B) : apport anthropisé conduisant à un cycle simplifié d'assimilation/décomposition.
Les effets ultimes d'un excès de phosphore conduisent à remplacer une chaîne alimentaire complète par un cycle simplifié d'assimilation/décomposition. Si la première, par sa diversification, aboutit au poisson tout en contribuant à éclaircir l'eau et à maintenir de l'oxygène au fond, le second, dominé par le monde bactérien, provoque, entre autres, la disparition du poisson et le relargage du phosphore piégé dans les sédiments (fig.4). La biodiversité se trouve considérablement réduite au profit d'espèces qui s'opposent à l'élimination du phosphore de la colonne d'eau. Cette modification biocénotique vient renforcer l'effet de la charge interne pour assurer un fonctionnement autonome à l'écosystème lacustre stricto sensu et lui permettre de résister à tout effort de réduction de la charge externe.
Proliférations algales, y compris cyanobactériennes, et
désoxygénation peuvent très bien se produire en conditions naturelles, mais les
cas sont rares et liés à des circonstances particulières : bassin versant
naturellement fertile, plan d'eau abrité, importantes déjections animales …Même
des lacs réputés pour leur pureté comme le lac d'Annecy sont le siège chaque été
d'une désoxygénation des eaux de fond sans conséquence pour leur état trophique,
et des cyanobactéries fixatrices d'azote peuvent apparaître en automne en raison
d'apports de phosphore dus à des remontées d'eaux hypolimniques ou à l'excrétion
animale.
D'anecdotique en conditions naturelles ou peu anthropisées, la dégradation des
milieux ralentis ou stagnants s'est généralisée et son intensité a crû en raison
de l'augmentation considérable des flux de phosphore déversés dans le réseau
hydrographique superficiel au cours de ces 50 dernières années. En effet, depuis
la fin de la seconde guerre mondiale, les quantités de phosphore mis en œuvre
ont considérablement augmenté, conséquence d'un accroissement de la population
et de ses activités tant en intensité qu'en diversité, tous secteurs confondus.
Bien sûr l'industrie et l'agriculture sont concernées mais c'est le secteur
domestique qui contribue le plus à la pollution par les phosphates, la moitié du
phosphore déversé dans le réseau hydrographique provenant du quotidien le plus
banal : toilettes, lave linge, lave vaisselle, douche… Cette peu honorable
performance domestique résulte en partie de la généralisation de l'emploi de
substances lessivielles à forte concentration en tripolyphosphates qui a plus
que doublé les émissions d'origine physiologique (fèces, urine, sueur). Par
ailleurs, le développement de l'assainissement par le " tout à l'eau ",
perfectionné en " tout à l'égout ", soustrait la majeure partie du phosphore
émis aux processus de fixation par les sols et d'utilisation par les végétaux
terrestres. Enfin, le but des stations d'épuration classiques étant de
minéraliser la matière organique support de l'activité bactérienne, leurs rejets
contiennent du phosphore minéral, forme plus biodisponible pour les végétaux que
la forme organique présente dans l'effluent brut.
Les modifications biologiques et chimiques résultant de la pollution par les
phosphates finissent par poser des problèmes d'utilisation du milieu aquatique.
Le plus grave et, heureusement, le moins fréquent concerne la santé animale et
humaine.
Santé animale et humaine. Bien que les bassins de lagunage doivent une bonne part de leur efficacité sanitaire à des substances antagonistes des bactéries entériques sécrétées par des algues et des plantes aquatiques, certaines algues, et tout particulièrement les cyanobactéries, sont toxiques pour le règne animal. Les dommages sont variables en fonction de la toxicité des espèces algales et même des souches, mais aussi en fonction de la sensibilité des cibles, des possibilités d'amplification par bioaccumulation et des conditions de milieu. Si le zooplancton est le premier touché, quoique faiblement, le sont également les poissons, les amphibiens, les reptiles, les oiseaux et les mammifères, dont les animaux d'élevage, les animaux de compagnie et…l'homme. Des proliférations cyanobactériennes ont tué et tuent encore un peu partout du bétail ou des chiens qui en avaient consommé. Les parties atteintes sont principalement le foie et le système nerveux. L'homme n'étant pas habitué à boire de l'eau chargée d'algues sans la traiter au préalable, les cas d'empoisonnement humain sont rares. Généralement dus à des défauts de potabilisation leurs cibles sont des populations à risques comme cette épidémie de gastro-entérite qui, en 1988, fit 88 morts au Brésil, la plupart des enfants (Teixera et al., 1993) ou cette eau insuffisamment traitée qui, en 1996, fit mourir d'hépatite une cinquantaine de patients dans un centre d'hémodialyse, toujours au Brésil (Jochimsen et al., 1998). En Chine des études épidémiologiques sur la fréquence des cancers du foie ont conduit à soupçonner le rôle de toxines cyanobactériennes dans l'eau de boisson en plus de ceux du virus de l'hépatite B et de l'aflatoxine B1 provenant de maïs moisi (Yu, 1989, 1995). Mais n'est-ce pas également sur la base d'une étude épidémiologique chinoise (Xu Guang-Wei, 1981) que l'OMS faisait état de l'effet cancérigène du nitrate dans l'édition 1986 de ses Directives de Qualité pour l'Eau de Boisson ? Référence qui disparut dans les éditions ultérieures pour manque de preuve (WHO, 1996). Par contre, nombreux sont les troubles que peut provoquer l'ingestion orale, l'inhalation ou le simple contact : érythèmes divers, démangeaisons oculaires, maux de gorge, céphalées, diarrhées, nausées, vomissements...(Ressom et al., 1994).
Alimentation en eau potable. De multiples problèmes résultent de la présence d'une abondante biomasse algale, à fortiori s'il s'agit de cyanobactéries : diminution des performances des différentes étapes du traitement (filtration, floculation, désinfection) en relation avec les matières en suspension et en solution que représentent ces algues aussi bien que les modifications physico-chimiques qu'elles induisent (variabilité extrême du pH, présence de fer, de manganèse, de sulfures), colonisation du réseau par une faune parasite, développement d'odeurs et de goûts qui finissent par empoisonner et " parfumer " les dispositifs au charbon actif chargés de les éliminer, synthèse de trihalométhanes cancérigènes par action des produits de désinfection sur les molécules organiques, pour ne citer que l'essentiel.
Pêche amateur et professionnelle. Avant d'avoir à subir les méfaits de proliférations cyanobactériennes, les populations de poissons évoluent en quantité et en qualité en fonction du développement végétal engendré par les apports de phosphates. Une faible fertilité n'est capable d'entretenir qu'un faible peuplement pisciaire, les poissons pouvant être des salmonidés (truite, omble chevalier) qui affectionnent les eaux froides et bien oxygénées et dont l'intérêt gastronomique et économique est certain. Des concentrations croissantes de phosphore entraînent une augmentation de la quantité de poissons, mais le développement parallèle de la désoxygénation fait que les salmonidés finissent par céder la place aux cyprinidés (tanche, gardon) moins exigeants en oxygène et en température, jusqu'à ce que des épisodes paroxysmiques d'anoxie nocturne les éliminent également. Entre temps, le développement des plantes aquatiques et des algues filamenteuses a multiplié les difficultés rencontrées par le pêcheur autant au niveau de la mobilité de ses embarcations que de la performance de capture de ses engins de pêche.
Activités récréatives. Indépendamment de sa qualité
bactériologique, une eau dont la transparence mesurée au disque de Secchi est
inférieure à 1 mètre est interdite à la baignade surveillée. Par ailleurs,
l'entrave physique que constitue la présence de plantes aquatiques en abondance
gêne la pratique de nombreuses activités aquatiques et la présence en surface de
couches gélatineuses d'algues diversement colorées n'incite guère aux activités
de contact sans compter les problèmes de santé précédemment évoqués. Même si
l'eau n'est appréciée que pour son agrément visuel, l'odorat peut ne pas se
satisfaire des exhalaisons des masses végétales en voie de décomposition.
D'autres nuisances sont à mettre sur le compte de la pollution par les
phosphates. En accélérant le comblement de la cuvette par des matériaux
d'origine autochtone, elle participe non seulement à la réduction du volume
d'eau disponible pour la production électrique ou la régularisation des débits,
mais aussi à la disparition des eaux profondes, froides, où vivent les
salmonidés et où pompe le distributeur d'eau. Des organismes peu désirables
peuvent profiter de la richesse du biotope pour proliférer à l'excès, comme les
moustiques ou les escargots d'eau. Ces derniers sont les hôtes intermédiaires de
trématodes responsables de la bilharziose sous les tropiques et de la dermatite
du baigneur sous nos latitudes, indûment attribuée à la " puce du canard ". Le
bacille du botulisme, qui affectionne les sédiments organiques et peu profonds,
relargue, quand il fait chaud, des toxines capables de tuer des espèces
sensibles, particulièrement les oiseaux.
[R] Sensibilité locale et pollution globale
L'utilisation de l'eau pour véhiculer la pollution offre le
double avantage aux populations amont d'une évacuation et d'un traitement
gratuits. Gratuité du traitement à mettre sur le compte de cette fameuse "
autoépuration " à laquelle il est fait appel quand il n'est pas question
d'éviter une pollution ni d'investir dans son traitement. Encore faut-il savoir
de quel type de pollution il est question et quels sont les mécanismes
d'autoépuration mis en jeu. L'attention ayant été focalisée dès l'origine sur
des problèmes d'hygiène et de santé publique, la pollution bactériologique et
son support organique ont été les premiers concernés par une autoépuration à
deux composantes : la minéralisation de cette matière organique grâce à
l'oxygène dissous dans l'eau, et la dilution par les apports non pollués.
A l'extrême amont du réseau hydrographique, où le courant est rapide voire
torrentiel, l'oxygénation de l'eau et, par conséquent, la minéralisation de la
matière organique sont maximales. De plus, la pollution y est minime et
rapidement diluée par des eaux encore pures. A mesure que l'on progresse vers
l'aval le courant ralentit, la minéralisation se fait de moins en moins bien, la
pollution s'intensifie, le facteur de dilution diminue et l'autoépuration est de
moins en moins performante. Par contre le ralentissement de l'eau favorise le
dépôt de sédiments, supports potentiels de plantes aquatiques, ainsi que la
prolifération du phytoplancton. En effet, non seulement la diminution du taux de
renouvellement favorise la multiplication cellulaire mais la sédimentation des
particules entraîne une meilleure pénétration de la lumière donc une meilleure
photosynthèse. Qui plus est, les concentrations de phosphore vont en augmentant
vers l'aval, augmentation qui concerne l'eau du fait de la multiplication des
apports mais aussi les sédiments qui accumulent ce qui ne reste pas dans l'eau
pour le restituer quand les conditions s'y prêtent : brassage par les vagues,
bioturbation, variations de pH, désoxygénation avec disparition totale du
nitrate, transfert par les plantes aquatiques…
Cette différence amont/aval qui apparaît au sein des eaux courantes en raison du
ralentissement est encore plus marquée entre eaux courantes et eaux stagnantes.
En mettant en œuvre l'équivalent de ce qu'offrent les stations d'épuration comme
traitements physiques, chimiques et biologiques du fait du temps de séjour qui
les caractérise, les eaux stagnantes jouent naturellement un rôle épuratoire.
Une partie du phosphore est ainsi éliminée par sédimentation, le reste se
trouvant à la base d'une pyramide trophique dont le sommet est occupé par le
poisson. Tant que l'homme a été discret elles ont été d'inestimables sources
d'eau potable et de nourriture. Maintenant que l'eau a été élevée au statut de
véhicule privilégié de la pollution ces points bas du réseau hydrographique en
sont devenus les " dépotoirs ". Après que les différents usages auxquels ils
étaient destinés se soient détériorés, ils deviennent de véritables sources de
nuisances quand ils rendent l'ultime " service gratuit ", celui du lagunage sans
entretien. Point bas définitif du réseau hydrographique continental, la mer
n'échappe pas à ce destin.
Le principe de " l'azote facteur limitant en milieu marin " est dû à Brandt qui l'énonça il y a plus de 100 ans, après l'avoir établi pour les eaux douces (Smith, 1998). Par la suite, alors que l'azote était toujours considéré comme facteur limitant des eaux marines, le phosphore finissait par le remplacer dans le cas des eaux douces. Il faut déjà bien reconnaître qu'en balayant tous les niveaux de complexité systémique, du plus petit, la culture d'algues, au plus grand, le lac en vraie grandeur, les recherches menées en eau douce offraient des bases particulièrement solides à la reconnaissance du rôle limitant du phosphore. Beaucoup plus solides en tout cas que celles qui permettaient à l'azote d'accéder à son statut de facteur limitant en milieu marin, ce dernier interdisant l'expérimentation en vraie grandeur, l'ultime degré de complexité, le seul véritablement démonstratif, celui qui avait été décisif en eau douce (Hecky et Kilham, 1988). Il convient également de prendre en compte la diversité du milieu marin en commençant par distinguer le milieu pélagique du milieu côtier.
Milieu pélagique. Relativement isolé, le milieu
pélagique vit de façon autonome. Les nutriments présents dans l'eau présentent
un rapport N/P proche de celui de la composition planctonique du fait qu'ils
proviennent pour l'essentiel de la régénération par le plancton et qu'en retour
ils sont consommés proportionnellement à ce même rapport. A l'occasion
d'upwellings qui font remonter des eaux relativement plus riches en phosphore
les cyanobactéries marines fixent l'azote nécessaire au rétablissement du
rapport N/P qui correspond à la composition planctonique. Une telle constance du
rapport N/P de l'eau de mer et sa coïncidence avec celui du plancton témoigne du
contrôle de la composition du milieu par les organismes (Redfield, 1958). Bien
que cette situation d'équilibre fasse apparaître l'azote comme autant limitant
que le phosphore, donc plus souvent qu'en eau douce, les épisodes d'activité des
fixatrices d'azote démontrent qu'en fait, le milieu est limité par le phosphore.
Cet équilibre ne peut être observé que dans les océans, leurs dimensions
garantissant au milieu pélagique l'autonomie nécessaire. La situation est
différente pour les mers et à plus forte raison pour les golfes qui subissent
l'influence des apports du continent, des sédiments, voire des océans. C'est
ainsi que les mers qui entourent la Suède présentent un gradient de salinité
décroissant du sud au nord depuis le Skagerrak qui touche la mer du Nord jusqu'à
l'extrême nord du golfe de Botnie, en passant par le Kattegat et la Baltique
proprement dite. Il est admis qu'à ce gradient de salinité correspond un "
gradient de limitation " : alors que le Skagerrak, le Kattegat et la Baltique
seraient limités par l'azote, le sud du golfe de Botnie le serait par l'azote et
le phosphore à la fois, et le nord par le phosphore seul. En fait, les
cyanobactéries interviennent pour rééquilibrer le rapport N/P en fonction des
apports d'origine terrestre et éventuellement sédimentaire, ce qui signifie que
ces mers sont limitées par le phosphore à l'échelle du système (Hellström,
1998).
Quant à la Méditerranée, elle est connue pour constituer à l'échelle mondiale la
plus grande masse d'eau en permanente oligotrophisation. Ce phénomène s'explique
par l'existence d'un courant d'eaux superficielles atlantiques relativement
pauvres en nutriments qui, au travers du détroit de Gibraltar, vient combler un
déficit hydrique provoqué par une évaporation supérieure aux apports d'eau
douce, d'où la formation d'un contre-courant de fond qui chasse vers l'océan
Atlantique les eaux profondes méditerranéennes, riches en nutriments. Il résulte
de ce mécanisme remarquable une oligotrophie croissant dans le sens du courant
superficiel atlantique, c'est à dire d'Ouest en Est (Stumm et Morgan, 1970). Ce
gradient d'oligotrophie s'accompagne d'une limitation par le phosphore qualifiée
de " paradoxe nutritionnel " (Berland et al., 1980) tellement est
enraciné le principe de la limitation par l'azote en milieu marin. Gradient
d'oligotrophie et limitation par le phosphore ont tous deux été confirmés encore
récemment (Moutin et Rimbaud, sous presse). Mais que la Méditerranée soit
limitée par le phosphore n'empêche pas certains de considérer les apports
d'azote comme susceptibles d'y développer l'eutrophisation (Seitzinger et
Kroeze, communication à ce colloque).
Milieu côtier. Malgré sa très forte diversité
apparente, le milieu côtier peut se partager sur la base de critères
hydrodynamiques entre zones exposées et zones abritées, ce qui équivaut à la
distinction entre " courant " et " stagnant " pratiquée en eau douce. Dans les
premières, l'intensité des processus d'advection et de mélange ne laissent pas
le temps aux processus biologiques d'intervenir sur le rapport N/P si bien qu'au
niveau de l'écosystème la production est limitée par un facteur autre que
l'azote ou le phosphore (autre nutriment, lumière, température…), même si la
croissance spécifique d'un organisme individuel peut être limitée à un moment
donné par la concentration locale d'azote ou de phosphore (Smith, 1984).
La situation est totalement différente quand la zone est abritée, la faiblesse
de l'hydrodynamique laissant la possibilité de s'exprimer à toutes sortes de
processus en fonction des divers apports, à commencer par ceux du continent.
Bien que du fait de leur salinité les eaux marines littorales soient considérées
comme appartenant au milieu marin, d'un point de vue fonctionnel et avec le
recul de la vision satellitaire elles apparaissent surtout comme l'ultime point
bas du réseau hydrographique continental. En conditions naturelles, ou de faible
anthropisation du continent, ces zones sont limitées par le phosphore (Smith,
1984). Parmi celles-ci les plus fragiles sont les écosystèmes estuariens dans
lesquels se déversent les apports continentaux car ils sont caractérisés par une
exceptionnelle productivité naturelle en relation d'une part avec leur situation
aval ultime qui leur assure une fertilité potentielle maximale et d'autre part
avec des conditions spécifiques qui leur permettent d'exprimer au mieux cette
fertilité potentielle.
La première de ces conditions résulte de ce qu'en se rencontrant, des eaux de
force ionique différente engendrent un phénomène de floculation à l'origine du
fameux " bouchon vaseux ". L'accumulation de matières organiques entraîne
l'établissement de conditions réductrices qui provoquent une perte d'azote par
dénitrification et un relargage de phosphore par réduction des composés
ferriques. Cette charge interne de phosphore est d'autant plus forte que la
réduction des sulfates amenés par l'eau de mer immobilise le fer sous forme de
sulfure et réduit d'autant la capacité de fixation du sédiment vis à vis du
phosphore. Par ailleurs, à marée basse, au niveau de la mince couche d'eau qui
recouvre un sédiment assombri par le sulfure de fer et chauffé par le soleil, la
minéralisation de la matière organique est particulièrement active et libère un
phosphore immédiatement biodisponible. Enfin, vagues et marées ont pour effet de
mettre tout ce phosphore à disposition du végétal comme dans les grands plans
d'eau peu profonds, plutôt que de le perdre dans les sédiments, comme dans les
lacs profonds stratifiés.
Tant que le phosphore est injecté de façon parcimonieuse, il reste facteur
limitant tout au cours de l'année comme dans l'estuaire de la Göta älv, rivière
alimentée par les eaux pauvres en phosphore du lac Vänern (Suède), le plus grand
lac de Scandinavie (Conley, 2000) ou dans celui de la baie d'Apalachicola en
Floride ou encore dans certains estuaires de la côte hollandaise qui reçoivent
des eaux où le phosphore est sévèrement contrôlé, (Howarth et al., 2000).
Compte tenu de l'augmentation colossale des apports anthropiques depuis les
temps préhistoriques, plus marquée pour le phosphore que pour l'azote, de tels
écosystèmes sont devenus particulièrement rares (Conley, 2000). La plupart ont
subi de profondes modifications En un premier temps, on constate que l'azote
limite la croissance végétale en été, alors que le phosphore continue à limiter
la poussée printanière. Ce changement saisonnier de facteur limitant n'a rien
d'exceptionnel (Conley, 2000). Il est du à l'augmentation estivale du flux de
phosphore relargué par le sédiment auquel s'ajoute un éventuel supplément de
charge externe du à l'accroissement saisonnier de l'activité humaine, en
relation notamment avec le tourisme. En progressant, la pollution par les
phosphates fait que la limitation printanière par le phosphore s'estompe et que
celle par l'azote finit par sévir toute l'année, jusqu'à ce qu'un nouveau
facteur limitant intervienne, généralement la lumière.
Si cette évolution au cours des saisons et au fil de la pollution est tout à
fait semblable à celle qui sévit en eau douce, la progression spatiale du
phénomène de dégradation présente également les plus grandes similitudes. De
même que dans un lac les premières manifestations se produisent sur les berges
sous forme d'algues filamenteuse et périphytiques, en mer ce sont les plages qui
sont envahies par les macroalgues. Par la suite, c'est la masse d'eau qui est
touchée par d'intenses proliférations phytoplanctoniques, aux " fleurs d'eau "
des limnologues correspondant les " efflorescences " des océanographes,
lesquelles finissent, les unes comme les autres par éliminer quasiment tout
autre forme de vie animale et végétale. Les pertes d'usage liées à cette
dégradation du milieu sont également semblables, il n'y a guère que la
potabilité de l'eau qui ne soit pas concernée en milieu marin, et pour cause !
En fait, la véritable différence porte sur les dimensions, aussi bien celles des
dégâts, superficies touchées et masses végétales produites, que celles des
moyens à mettre en œuvre pour lutter contre le fléau, ce qui implique également
une différence au niveau des chances de succès.
Comme il vient d'être décrit dans les lignes précédentes, en conditions fortement anthropisées, le phosphore cède sa place de facteur limitant à l'azote. Le déficit relatif d'azote étant automatiquement comblé par les cyanobactéries fixatrices d'azote ce dernier ne peut pas limiter la prolifération du végétal aquatique au niveau de l'écosystème, si bien que la poursuite du processus d'anthropisation fait qu'à son tour il cède sa place au carbone, l'élément nutritif limitant qui lui succède sur la liste du tableau 1. En fait, à cause de l'auto-ombrage, c'est un facteur limitant énergétique qui intervient, la lumière, ce qui a pour effet de stimuler à nouveau des cyanobactéries, mais pas les mêmes.
Intervention sur les apports. Si, dans des conditions
d'azote limitant, le gestionnaire veut augmenter la prolifération algale, par
exemple pour accroître la production piscicole, il peut rajouter de l'azote,
comme le ferait un agriculteur pour augmenter sa production céréalière. Mais il
peut également rajouter du phosphore puisque les cyanobactéries fixatrices
interviennent automatiquement pour rajouter l'azote manquant. D'ailleurs dans
son fameux traité de pisciculture Arrignon n'écrivait-il pas que " le
phosphore comme élément nutritif augmente le rendement en phytoplancton et en
zooplancton et qu'il favorise en outre la fixation de l'azote par les bactéries.
Un apport de nitrate de soude ou d'engrais ammoniacaux n'a pas d'intérêt
évident. " (Arrignon, 1976).
Par contre, si, plutôt que de les augmenter, le gestionnaire veut stabiliser les
proliférations algales, il peut envisager d'intervenir sur l'azote, sachant que
cette intervention ne peut que stimuler l'activité compensatrice des fixatrices
d'azote, ce qui est écologiquement risqué. S'il compte améliorer
substantiellement la qualité de l'eau en respectant la norme des 50 mg/l de
nitrate (11 mg/l d'N), édictée pour des raisons de santé publique et non
d'environnement, il lui faudra se contenter d'un milieu où les algues
prolifèrent à un équivalent de 11/7,2 = 1,5 mg/l de phosphore c'est à dire à peu
près aussi attrayant qu'un bassin de lagunage. Et si son intention est de
ramener les proliférations algales au voisinage de ce qu'elles pourraient être
dans un plan d'eau à vocation touristique (# 0,020 mg/l de P), ou même à forte
productivité piscicole (# 0,200 mg/l de P), intervenir sur l'azote nécessiterait
de ramener sa concentration à une valeur voisine de 0,144 mg/l de N (0,660 mg/l
de nitrate) dans le premier cas, c'est à dire inférieure au bruit de fond
naturel, ce qui est techniquement impossible, et à 1,44 mg/l d'azote (6,60 mg/l
de nitrate) dans le second cas, ce qui reste encore du domaine de l'exploit, les
deux situations étant bien évidemment de nature à stimuler les fixatrices
d'azote à l'extrême. Enfin, proposer de lutter contre la pollution par les
phosphates en traquant le nitrate ne relève-t-il pas d'une logique pour le moins
confuse ? Par contre, il est vrai que de réduire les concentrations de phosphore
pour le rendre limitant a pour effet de réduire l'activité des fixatrices
d'azote et par conséquent de réduire les concentrations de nitrate.
Que la pollution par les phosphates rende l'azote limitant dans un espace/temps
restreint ne fait aucun doute. En inférer que l'azote est limitant à l'échelle
de l'écosystème, c'est ignorer le rôle des fixatrices d'azote. Et vouloir, dans
ces conditions, utiliser l'azote comme facteur de maîtrise est à la fois
techniquement impossible et écologiquement risqué. C'est toujours le phosphore
qu'il convient de réduire globalement, c'est toujours lui le facteur de
maîtrise. Mettre quelque condescendance à reconnaître que " la prévention de
la croissance des algues s'appuie souvent sur une limitation des niveaux de
phosphates, simplement parce qu'il s'agit du paramètre le plus facilement
influençable " comme le fait le Comité Scientifique pour les Phosphates en
Europe (SCOPE, 1992), c'est ignorer que si le phosphore est plus facile à
raréfier que l'azote, ce n'est pas pour de " simples " raisons de facilité
technique mais bien parce que, fondamentalement, la nature l'a fait plus rare
que l'azote.
Cette stratégie d'intervention peut sembler novatrice pour certains, déplacée
pour d'autres, tant l'idée de la responsabilité du nitrate est ancrée dans les
esprits. Ancrage facilité déjà par une certaine (mauvaise) volonté à voir de l'"
eutrophisation " là où sévit la " pollution par les phosphates ". Mais ancrage
facilité surtout par l'application d'une version " adaptée " du concept originel
de facteur limitant : puisque pour augmenter une production céréalière il suffit
d'augmenter le facteur limitant, pour réduire les proliférations algales il
suffit de réduire ce même facteur limitant, et s'il est " scientifiquement
prouvé " que l'azote est le facteur limitant, c'est l'azote qu'il convient de
réduire. Raisonnement qui témoigne d'une totale méconnaissance de l'abîme qui
sépare l'augmentation d'une production céréalière de la diminution de
proliférations algales, ne serait-ce que du point de vue de l'activité des
fixatrices d'azote. Procédant sans doute d'un fort louable souci d'économie de
pensée ce raisonnement présente cependant l'avantage considérable d'être simple,
d'où son succès. Cela fait pourtant une quarantaine d'années que le limnologue
suisse E.A. Thomas a établi les bases de la maîtrise des proliférations algales
sur le phosphore et non sur l'azote, les deux principaux arguments étant que, en
conditions naturelles, la pluie et les tributaires contiennent beaucoup moins de
phosphore que d'azote et que des bactéries et des cyanobactéries sont capables
de fixer l'azote gazeux en cas de déficit relatif (Thomas, 1962).
Si le mal est pris à temps, une simple diète phosphorée permet de revenir
rapidement à un état proche de l'originel. Encore faut-il que la diète soit
suffisante pour ramener la charge externe au voisinage de ce qu'elle était à
l'origine : il ne faut pas espérer éliminer 100% de l'effet en ne réduisant la
cause que de 50 %, a fortiori quand la relation de cause à effet est plus
sigmoïdale que linéaire, et qu'on se trouve " en bout de plateau ", ce qui est
bien souvent le cas. Compte tenu de l'aptitude des sols à fixer le phosphore et
des végétaux terrestres à le consommer, cette mise à la diète n'aurait dû
rencontrer que les problèmes techniques, et financiers, de l'élimination au "
fil de l'eau ". En fait, elle a surtout rencontré, et rencontre encore, les
oppositions économiques à la " suppression à la source ", mesure pourtant
primordiale et la seule à être globalement efficace.
Intervention sur le milieu récepteur. Il est certain
que de discuter pendant plus d'un demi-siècle de la responsabilité de l'azote ou
du phosphore, voire même du carbone, du phosphore des villes ou de celui des
champs, de celui du métabolisme ou de celui des détergents etc…tout en laissant
s'intensifier et se multiplier les apports de phosphore dans le milieu récepteur
ne pouvait qu'y intensifier et multiplier les problèmes au point que l'"
eutrophisation ", longtemps minimisée comme exception se révèle être la règle et
que les moyens à mettre en œuvre pour en venir à bout ne relèvent plus de la
simple diète.
En effet, si l'on attend que les cyanobactéries envahissent toute la masse d'eau
toute l'année et qu'une bonne partie du phosphore déversé s'accumule dans les
sédiments pour constituer une véritable bombe à retardement prête à exploser
sous forme de charge interne, une simple diète, même drastique, a de fortes
chances d'être inefficace. Il est nécessaire d'intervenir directement sur le
milieu en commençant par neutraliser cette charge interne. La façon la plus
radicale d'y parvenir est de draguer les sédiments susceptibles de relarguer du
phosphore. Si l'on renonce à extraire ces sédiments, des techniques sont
disponibles qui permettent d'empêcher leur phosphore d'atteindre la zone
trophogène. Et même si l'on renonce à la fois à réduire la charge externe et à
neutraliser la charge interne de façon efficace, il existe encore des techniques
qui permettent de gérer au moins mal les conséquences de ce double renoncement.
En fait, la limnologie opérationnelle offre toute une panoplie de moyens tant
préventifs que curatifs pour lutter contre la pollution par les phosphates (Barroin,
1999). Si leur mise en œuvre rencontre quelques difficultés, c'est moins par
manque de connaissances que par manque de motivation.
Mesures législatives. Ces difficultés à réduire le
flux global de phosphore parvenant en zone trophogène ne doivent pas servir de
prétexte à retirer au phosphore son rôle de facteur de maîtrise pour l'attribuer
à l'azote. Pas plus que l'aide apportée par la dénitrification au fonctionnement
d'une station d'épuration ne doit servir d'argument à la réalisation de cette
dénitrification pour lutter contre l'" eutrophisation ". Elles ne devraient pas
non plus conduire à pratiquer une épuration à deux vitesses réservant aux "
zones sensibles " un traitement complémentaire pour éliminer soit le phosphore,
soit l'azote, soit le phosphore et/ou l'azote, selon la formule consacrée
(Journal officiel des Communautés Européennes, 1991). Il est bien évident que
l'existence de zones continentales et littorales particulièrement fragiles
incite à y déverser directement le minimum de phosphore mais, compte tenu de
l'extrême solidarité du réseau hydrographique, ce n'est pas une raison pour
autoriser le laisser-aller à l'amont, au contraire. Ces zones fragiles ne
devraient pas être considérées comme des cas à part, des empêcheuses de polluer
en rond malencontreusement disposées sur le réseau hydrographique, mais
devraient plutôt servir d'" observatoires " témoignant de la dégradation
trophique de l'ensemble des eaux de surface, témoignage que ne peut apporter une
eau qui circule. Et c'est bien en se référant aux eaux courantes que l'Agence de
l'Eau Loire-Bretagne considérait en 1994 comme " très bonne " une eau
titrant jusqu'à 100 µg/l de phosphore total et " bonne " jusqu'à 300 µg/l. Quand
on sait que dans son fameux rapport réalisé en 1968 pour le compte de l'OCDE
Vollenweider concluait : " …il est probable qu'une eau est trophiquement en
danger quand ses concentrations printanières dépassent 10 mg P/m3 [=
10 µg/l] pour les combinaisons exploitables de phosphore… "
(Vollenweider, 1968), et que même une perception plus laxiste du problème
n'autorise guère plus de 50 µg/l de P.total moyen annuel (Barroin, 1989), il ne
faut pas s'étonner que la pollution par les phosphates se soit développée en
toute légalité. Il est vrai que, depuis, dans le cadre du Système d'Evaluation
de la Qualité de l'Eau des Cours d'Eau (S.E.Q. Eau) daté de janvier 2000, les
Agences de l'Eau ont revu les limites à la baisse, respectivement 50 et 200
µg/l. Quoi qu'il en soit, le texte de la CEE prescrit le traitement
complémentaire " à moins qu'il ne puisse être démontré que cette élimination
sera sans effet sur le niveau d'eutrophisation " ce qui condamne
définitivement les zones qui, polluées de longue date, ont accumulé dans leurs
sédiments suffisamment de phosphore pour constituer une charge interne efficace.
De nature à pratiquer la déphosphatation à l'économie, ces dispositions
législatives ont surtout pour résultat de renforcer le rôle limitant de l'azote
au fil de l'eau et au cours du temps, renforçant du même coup l'idée, fausse,
qu'il convient de dénitrifier plutôt que de déphosphater. Il est étonnant qu'une
telle vision cloisonnée du monde aquatique ait pu imprégner la loi quand on sait
à quel point le moindre soupçon de connexion d'une eau avec le réseau domanial
interdit d'y faire quoique ce soit sans autorisation. Seule une vision globale
est en mesure de préserver la qualité de l'eau pour plus tard, les futurs plans
d'eau, et pour plus loin, la mer à commencer par ces zones où prospèrent ulves,
entéromorphes et autres macroalgues.
Le milieu marin. C'est l'azote qui continue à
constituer la cible des réductions d'apports nutritifs en vertu du principe de
l'azote facteur limitant, renforcé par le constat que les zones à problèmes
finissent par être limitées par l'azote.
Il est cependant de plus en plus proposé de traquer le phosphore autant que
l'azote. Mis à part le principe des responsabilités partagées dont la logique
appartient plus au monde des assurances qu'à celui de la science, la raison
véritablement scientifique d'intervenir aussi sur le phosphore est de réduire
les poussées printanières qui sont à l'origine des problèmes ultérieurs de
désoxygénation benthique et de croissance rapide des macroalgues, le contrôle de
l'azote ne servant plus alors qu'à limiter les poussées estivales (Conley,
2000).
Les pays riverains des mers scandinaves reconnaissent la nécessité de réduire
les apports de phosphore pour améliorer la qualité des eaux. La seule question
qui reste en suspens est de savoir s'il ne faudrait pas également réduire les
apports d'azote, réduction justifiée d'une part par son efficacité résultant
d'une possible absence des fixatrices d'azote (Howarth et Marino, 1998) et
d'autre part par les risques de voir apparaître des dinoflagellés toxiques pour
un rapport N/P élevé ce qui peut être interprété comme une réaction du plancton
à un excès d'azote (Zevenboom et al., 1998), aussi bien qu'à un déficit
de phosphore (Skjoldal et Dundas, 1989). Quelle que soit l'interprétation
proposée, un événement toxique remarquable ne peut se produire que si le bloom
algal est lui même remarquable ce qui nécessite des concentrations de phosphore
qui ne peuvent que très rarement exister à l'état naturel. C'est donc bien la
pollution par les phosphates qui provoque les blooms phytoplanctoniques, et
c'est l'intervention d'autres facteurs, notamment l'abondance relative d'autres
nutriments tels que l'azote ou la silice, qui détermine le type de nuisance
engendré par ces blooms : marées mucilagineuses à diatomées, marées toxiques à
dinoflagellés…
Quant à ne traiter que le phosphore, comme en milieu d'eau douce, certains y
voient le danger de réduire la rétention de l'azote dans le système estuarien,
l'exportation du superflu en milieu pélagique ayant alors pour effet d'y
stimuler les algues (Conley, 2000), en vertu, bien sûr, du principe de l'azote
facteur limitant en milieu marin.
Non seulement le nitrate n'est pas la bonne cible pour lutter contre la pollution par les phosphates, mais, bien au contraire, il contribue à en traiter les conséquences les plus néfastes : les cyanophycées fixatrices d'azote et la charge interne en phosphore.
Les cyanophycées fixatrices d'azote. En augmentant le rapport N/P la présence de nitrate dans la zone trophogène empêche le développement des cyanobactéries fixatrices d'azote. C'est ainsi que des épandages de nitrate sont utilisés pour maîtriser les proliférations cyanobactériennes provoquées par 50 ans de fertilisation phosphorée dans des eaux consacrées à la pisciculture (Robin, 1999). Il ne faut cependant pas compter sur des apports de nitrate pour éliminer des espèces cyanobactériennes présentes pour des raisons de manque de lumière comme expliqué précédemment.
La charge interne de phosphore. Tant que le nitrate est présent à l'interface eau/sédiment, l'oxygène qu'il contient (O3 de NO3-) entretient l'oxydation des composés du fer et empêche le relargage du phosphore qu'ils fixent. De plus, la forme liquide du nitrate en solution permet de transférer de l'oxygène à des concentrations bien supérieures à celles que permet l'utilisation du gaz O2 qui s'échappe sous forme de bulles dès qu'il est en sursaturation. L'injection de nitrate de calcium (Ca (NO3)2) dans les sédiments constitue une méthode de traitement appelée " Méthode Riplox " du nom de son inventeur Willy Ripl (Ripl, 1976). L'azote moléculaire N2 produit par la dénitrification se dissout dans l'eau et s'échappe vers l'atmosphère en cas de sursaturation. L'éventuel excès de nitrate contribue à empêcher le développement de fixatrices d'azote. La méthode prévoit d'ajouter du fer (Fe Cl3) pour assurer la fixation du phosphore, ainsi que de la chaux (Ca OH2) pour obtenir un pH propice à la dénitrification (fig. 5).
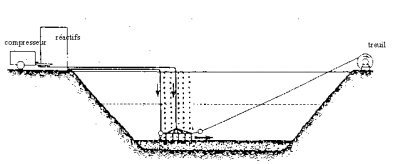
Fig. 5 : Dispositif utilisé pour traiter les sédiments selon la méthode Riplox (d'après Ripl, 1981)
Il est également possible de traiter un lac en déversant au contact du sédiment des effluents domestiques déphosphatés et nitrifiés, le nitrate produit en station d'épuration jouant le même rôle que celui du commerce utilisé dans la méthode Riplox (Leonardson et Ripl, 1980).
En fait, proposer d'éliminer le nitrate pour lutter contre la
pollution par les phosphates résulte de l'application incorrecte du concept de
facteur limitant et de l'utilisation abusive du terme d'" eutrophisation ". Ce
qu'illustre parfaitement le chemin parcouru par la CEE pour en arriver à définir
l'" eutrophisation " comme elle l'a fait dans sa Directive du 12/12/1991 citée
en introduction :
1- dans son texte de projet de directive " Nitrates " du 22/12/1988 la
Commission reconnaît que : " la croissance normale des algues requiert
environ dix fois plus d'azote que de phosphore. Dans la plupart des eaux douces,
la quantité d'azote disponible par rapport à celle du phosphore dépasse cette
proportion si bien que le phosphore est souvent l'élément nutritif qui limite la
croissance des algues ", ce qui est parfaitement exact,
2- elle propose alors de définir l'" eutrophisation " comme "
l'enrichissement de l'eau en éléments nutritifs lorsque l'azote est le facteur
limitant, provoquant…", proposition qui sous-entend que l'excès de
phosphore est bien à l'origine du " développement accéléré des algues et des
végétaux d'espèces supérieures… "
3- pour en arriver à la définition de la Directive du 12/12/1991 : "
l'enrichissement de l'eau en composés azotés, provoquant… ", définition
qui a le mérite de ne pas s'encombrer de sous-entendu et de faire de l'azote
l'unique objet de l'attention du gestionnaire.
Ce glissement sémantique doit beaucoup au travail de communication réalisé
depuis plus de trente ans par les industriels du phosphore lessiviel pour sauver
l'image de marque de leur produit (Shapiro, 1988 ; Edmonson, 1991 ; Barroin,
1995). Du coup, le phosphore, toutes origines confondues, se trouvait innocenté,
laissant sur le banc des accusés l'hydrodynamique, la température, la lumière,
les oligo-éléments, les écotoxiques, le potassium, le carbone…et, bien sûr,
l'azote. Le nitrate faisait un coupable d'autant plus acceptable que la
recherche médicale les accusait par ailleurs de tuer les nourrissons et de
provoquer le cancer, que les océanographes voyaient dans l'azote le seul et
unique facteur limitant du milieu marin, et que l'agronomie faisait de la lutte
contre le nitrate son plus fougueux cheval de bataille environnementale.
Il ne faut pas non plus négliger la part de responsabilité qui incombe à la
méthode scientifique dans la constitution du dossier d'accusation du nitrate. En
effet, de nature essentiellement réductioniste et expérimentale, elle attribue
le rôle de facteur limitant sur la base de travaux nécessairement conduits à une
échelle réduite de temps et d'espace. Qu'il s'agisse d'analyse physicochimique
du milieu, de détermination de la composition tissulaire, ou de tests de
fertilité, l'échelle de l'étude est celle qui convient aux " bonnes pratiques
scientifiques " avant d'être celle à laquelle se pose le problème c'est à dire
celle de l'écosystème limnique, si ce n'est celle de l'hydrosystème continental,
voire planétaire. La réelle difficulté n'est pas de conduire correctement les
travaux de recherche à l'échelle locale du laboratoire mais d'inférer
correctement la réalité à l'échelle globale de l'écosystème à partir des
résultats de ces travaux. La modélisation mathématique est l'instrument
privilégié pour réaliser cette inférence en raison de ses capacités
opérationnelles, encore faut-il qu'elle repose sur des bases conceptuelles
saines. Si tel n'est pas le cas, elle n'a pas pour vocation de corriger les
défaillances, elle a surtout pour effet de les valider.
Peut être faut-il évoquer à ce propos l'inaptitude conceptuelle fondamentale
qu'éprouve l'homo sapiens à concevoir l'extrême réactivité et l'extrême
solidarité du monde aquatique. Depuis des millénaires, il est habitué à la
lenteur des réactions propres au milieu terrestre et à leur puissant ancrage
dans le sol, support dont la stabilité est passablement fiable. En jouant de ses
pratiques agricoles sur des portions d'espace/temps sélectionnées il domestique
ces réactions pour les adapter à ses besoins en quantité, en qualité et en
vitesse. Peu de temps après avoir mis en évidence la carence en phosphore dont
souffraient les sols européens au milieu du 19 ème siécle, il a découvert de
considérables gisements de phosphates qui lui ont permis de remédier à cette
carence. Devant la lenteur des légumineuses et autres fixateurs naturels d'azote
à satisfaire spontanément les besoins azotés des cultures soumises à une intense
fumure phosphorée, l'homo industrialis est devenu lui même un puissant
fixateur d'azote. Dans ces conditions, il lui est difficile d'imaginer avec
quelle rapidité le milieu aquatique voit les fixatrices d'azote remédier à une
carence azoté en n'importe quel endroit dès que les conditions leur sont
favorables et à quel point il est illusoire de vouloir intervenir localement sur
l'azote sous prétexte qu'il est tout aussi localement limitant. Le fait que l'"
eutrophisation " ait constamment été considérée comme un phénomène local traduit
bien cette inaptitude conceptuelle. Quant à la différence de délimitation
géographique des " zones sensibles " entre novembre 1987 et décembre 1994,
notamment en ce qui concerne le bassin de la Loire et la région parisienne,
témoigne-t'elle d'une réelle évolution de la situation ou plutôt de la
difficulté qu'a l'administration à dépecer la solidarité aquatique ? Au point
qu'en superposant les deux cartes c'est presque l'ensemble du territoire
français qui apparaît touché par ce fléau réputé " local " (fig. 6).
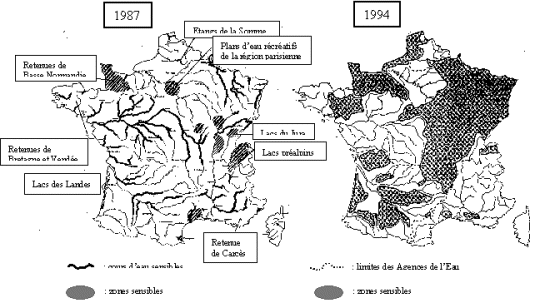
Fig. 6 : Cartes des " zones sensibles à l'eutrophisation " de 1987 (Ministère de l'Environnement-Agences de l'Eau 11/1987) et 1994 (Arrêté du 23/11/1994)
Au fil des décennies, les divers spécialistes de la gestion
environnementale des eaux de surface s'accordant à reconnaître au phosphore sa
qualité de facteur de maîtrise des proliférations végétales aquatiques, on
pouvait imaginer le nitrate innocenté. C'était sans compter sur l'insistance
d'experts totalement étrangers à ce domaine de compétence à voir dans l'azote le
responsable de l'eutrophisation. " C'est dans les lacs et les rivières que
l'on a observé les premières manifestations de la pollution par les nitrates.[…]
Ce phénomène que l'on appelle eutrophisation… " (Fritsch et De Saint
Blanquat, 1985). Cette introduction à un article sur la toxicité du nitrate
rédigé par des spécialistes de la santé permettait d'ajouter d'entrée le poids
d'un délit contre l'environnement à la lourde charge qui allait être ensuite
développée pour ses délits contre la santé. Même s'il est reconnu que le nitrate
non seulement n'est pas à l'origine de nitrosamines cancérigènes mais que "
moreover, there is now evidence that the conversion of nitrate into oxydes of
nitrogen prevents the formation of carcinogenic nitrosamines " il est de bon
ton de conclure que " …there are still good reasons for limiting nitrate
levels in[…]river systems. " car " high nitrate level in river
systems will result in considerable environmental problems such as algal blooms.
" (Duncan et al.,1997). Et quand son parent, l'ammoniac, dont les
retombées sont supposées avoir un rôle néfaste sur la santé humaine se trouve
lavé de tout soupçon, il est rappelé que ces retombées " peuvent avoir un
effet déterminant sur le fonctionnement [des] écosystèmes : […]
eutrophisation des eaux et des milieux naturels… " (Morvan et al.,
1999). Pourquoi évoquer, à tort, l'eutrophisation alors que l'azote ammoniacal
est parfaitement connu autant pour la forte toxicité potentielle que pour la
forte demande d'oxygène qu'il exerce sur le milieu récepteur ?
Que des écrits concernant la santé en appellent ainsi à l'environnement ou que,
réciproquement, la méthémoglobinémie du nourrisson soit évoquée pour expliquer
la toxicité du nitrate à l'égard de certains amphibiens californiens (Rouse
et al. 1999) n'est pas sans rappeler la position du Ministère de
l'Aménagement du Territoire et de l'Environnement à propos de la toxicité du
nitrate vis à vis de l'homme. En effet, dans un texte destiné à confirmer la
réalité de cette toxicité, la démonstration commence étonnamment par : " Si
l'on se place au plan de la santé humaine et animale, il ne faut certes
pas exagérer les dangers directement liés aux nitrates " et tout le reste de
l'argumentation s'appuie sur des considérations environnementales introduites
par " La directive européenne sur les nitrates (1980) qui organise la
maîtrise de la pollution des eaux par les nitrates d'origine agricole, [et
qui] vise également la protection des milieux naturels et des écosystèmes
perturbés par un excès d'azote ".( Ministère de l'Aménagement du
Territoire et de l'Environnement, 1996. ) Cette pratique qui consiste à déplacer
le champ du débat pour y faire briller des propos hors sujet, faute de pouvoir
argumenter dans le strict domaine concerné, relève du discours politique. Elle
n'a pas sa place au sein des activités scientifiques dont le but n'est pas
d'avoir raison mais de connaître la vérité.
En conditions naturelles, du fait qu'il est relativement plus
abondant que le phosphore pour satisfaire les besoins nutritionnels des végétaux
aquatiques, l'azote ne peut pas limiter leur croissance. Le facteur limitant,
c'est le phosphore.
La pollution par les phosphates fait perdre au phosphore son statut de facteur
limitant au profit de l'azote, ceci à la lumière de travaux de laboratoire
forcément conduits à une échelle réduite d'espace et de temps. En fait, à
l'échelle de l'hydrosystème elle a pour effet de stimuler la fixation de l'azote
par des organismes spécialisés (cyanobactéries), le déficit relatif d'azote
d'origine anthropique étant ainsi comblé par de l'azote d'origine atmosphérique
disponible en quantité illimitée. La croissance végétale dépend donc encore des
seuls apports de phosphore : le facteur limitant, c'est encore le phosphore.
La croissance incontrôlée des végétaux aquatiques en réponse à la pollution par
les phosphates a pour conséquence de modifier profondément la structure et le
fonctionnement des hydrosystèmes en relation notamment avec la prolifération des
cyanobactéries, algues particulièrement nuisantes. Ces modifications
s'accompagnent d'une dégradation de la qualité de l'eau qui équivaut à celle
provoquée par la pollution organique et qui se traduit par des pertes d'usage
touchant de nombreux intérêts économiques voire vitaux.
Pour remédier à cette situation il est inutile, voire nuisible d'intervenir sur
l'azote. Le facteur de maîtrise, c'est le phosphore. En effet :
- 1) toute réduction de l'azote est globalement vouée à l'échec du fait de
l'activité compensatrice des fixatrices d'azote et seule une réduction des
phosphates peut venir à bout des cyanobactéries, qu'elles soient ou non
fixatrices d'azote.
- 2) seule une réduction du phosphore permet de ramener la prolifération
végétale à une valeur proche de ce qu'elle est en conditions naturelles ; toute
réduction de l'azote ne peut qu'éventuellement arrêter le processus de
dégradation au niveau atteint quand la situation est suffisamment catastrophique
pour qu'on s'y intéresse, ce qui est parfaitement insuffisant et ce qui suppose
l'absence de l'activité compensatrice des fixatrices d'azote à tout instant et
en tout point de l'hydrosystème, supposition intenable.
Non seulement réduire les apports de nitrate n'est pas le bon moyen de lutter
contre la pollution par les phosphates mais la présence de nitrate contribue à
lutter contre deux conséquences particulièrement fâcheuses de cette pollution :
la charge interne de phosphore et les cyanobactéries fixatrices d'azote. Il est
cependant hors de question qu'un ajout de nitrate puisse venir à bout des
cyanobactéries non fixatrices d'azote. Leur présence résultant d'un manque de
lumière provoqué par l'auto-ombrage du phytoplancton stimulé par les apports de
phosphore, leur élimination ne peut résulter que d'une intervention sur ces
derniers.
Alors que la pollution par les phosphates concerne l'ensemble du réseau
hydrographique en suivant un gradient amont-aval, les excès de végétation,
témoins de cette pollution, ne touchent que les zones suffisamment calmes pour
permettre aux algues et aux herbiers de proliférer et de se multiplier. Quand
l'ensemble fonctionnel [écosystème récepteur + bassin versant] est de taille
limitée et que la pollution par les phosphates dont il est l'objet est de faible
intensité, ou qu'elle n'est pas trop ancienne, il est relativement aisé
d'améliorer la qualité de l'écosystème. Par contre, les milieux de grande taille
ayant reçu depuis longtemps d'importantes quantités de phosphore mises en
mémoire dans les sédiments sont très difficilement récupérables.
Ce constat concerne également le milieu marin, pas fondamentalement différent du
milieu d'eau douce, à commencer par les zones estuariennes. Exceptionnelles par
leur fertilité naturelle elles le sont aussi par leur fragilité, en raison
notamment de leur positionnement à l'aval ultime du réseau hydrographique
continental. Et ce ne sont pas des mesures locales visant " l'azote et/ou le
phosphore ", quand ce n'est pas l'azote seul, qui risquent d'améliorer leur
état.
Arrignon, J., 1976. Aménagement écologique et
piscicole des eaux douces. Gauthier-Villard, Paris, 329 p.
Barroin, G., 1989. Conflits d'usage ou plages de qualité ? Actes du Colloque "La
gestion environnementale des plans d'eau". Aix-les-Bains, Juin 1989, IIGGE,
8 p.
Barroin, G., 1995. Les phosphates ou comment manipuler la science. La
Recherche, 281 : 56-60.
Barroin, G., 1999. Limnologie appliquée au traitement des lacs et des plans
d'eau. Les Etudes des Agences de l'Eau, N°62 : 215 p.
Berland, B.R., Bonin, D.J. & Maestrini, S.Y., 1980. Azote ou phosphore ?
Considérations sur le " paradoxe nutritionnel " de la mer méditerranée.
Oceanol.Acta, 3(1) : 135-141.
Conley, D.J., 2000. Biogeochemical nutrient cycles and nutrient management
strategies. Hydrobiologia, 410 : 87-96.
Duncan, C., Li, H., Dykhuizen, R., Frazer, R., Johnston, P., MacKnight, G.,
Smith, L., Lamza, K., McKenzie, H., Batt, L., Kelly, D., Golden, M., Benjamin,
N. & Leifert, C., 1997. Protection against oral and gastrointestinal diseases :
importance of dietary nitrate intake, oral nitrate reduction and enterosalivary
nitrate circulation. Comp. Biochem. Physiol. 118A(4) : 939-948.
Edmondson, W. T., 1991. The uses of ecology : Lake Washington and beyond.
University of Washington Press, Seattle and London, 327 p.
Fritsch, P. & de Saint Blanquat, G., 1985. La pollution par les nitrates. La
Recherche 169 : 1106-1115
Gunisson, D., Engler, R.M. & Patrick, W.H., Jr., 1985. Chemistry and
microbiology of newly flooded soils :relationship to reservoir-water quality.
In : Gunisson D. (ed) Microbial processes in reservoirs. Developments
in Hydrobiol., 27 : 39-57.
Haynes, R.C., 1988. An introduction to the blue-green algae (cyanobacteria) with
an emphasis on nuisance species. North American Lake Management Society,
Washington, DC, 19 p.
Hecky, R.E. & Kilham, P., 1988. Nutrient limitation of phytoplankton in
freswater and marine environments : a review of recent evidence on the effect of
enrichment. Limnol. Oceanogr.,33(4, part 2) : 796-822.
Hellström, T.,1998. Why nitrogen is not limiting production in the seas around
Sweden. Effects of Nitrogen in the Aquatic Environment. The Royal Swedish
Academy of Sciences. KVA report : 11-22.
Howarth, R.W. & Marino, R., 1998. A mechanistic approach to understanding why so
many estuaries and brackisch waters are nitrogen limited. Effects of Nitrogen in
the Aquatic Environment. The Royal Swedish Academy of Sciences. KVA report :
117-136.
Jochimsen, E.M., Carmichael, W.W., An, J., Cardo, D.M., Cookson, S.T., Holmes,
C.E.M., Antunes, B.C., Melo, Filho, D.A., Lyra, T.M., Barreto, V.S.T., Azevedo,
S.M.F.O. & Jarvis W.R., 1998. Liver failure and death after exposure to
microcystins at a haemodialysis center in Brazil. New Engl. J. Med.
338(13): 873-878.
Journal officiel des Communautés Européennes, 1991. Directive du Conseil du 21
mai 1991 relative au traitement des eaux urbaines résiduaires, Article 5, Annexe
II.
KVA, 1998. Effects of nitrogen in the aquatic environment. The Royal Swedish
Academy of Sciences. KVA report 1998 : 1, 150 p.
Leonardson, L. & Ripl, W., 1980. Control of undesirable algae and induction of
algal succession in hypertrophic lake ecosystems. In Barica, J. & Mur,
L.R., (eds), Hypertrophic ecosystems. S.I.L. Workshop on hypertrophic ecosystems.
Developments in Hydrobiol., 2 : 57-67.
Ministère de l'Aménagement du Territoire et de l'Environnement, 1996. La
position du Ministère de l'Aménagement du Territoire et de l'Environnement, à
propos du livre de J. et J.-L. L'Hirondel : " les nitrates et l'homme, le mythe
de leur toxicité ". Direction Générale de l'Administration et du Développement,
note du Service de la Recherche et des Affaires Economiques, 20 décembre 1996, 1
p.
Morvan, T., Cellier, P., Génermont, S., Masson, S. & Loubet, B.,1999. Mesure et
calcul des teneurs en ammoniac dans l'atmosphère sous le vent de bâtiments
d'élevage et d'épandages de lisier. Rapport de fin de contrat INRA-InVS, 22 p.
Moutin, T. & Raimbault P. Primary production, carbon export and nutrients
availability in western and eastern Mediterranean Sea in early summer 1996
(MINOS cruise). J. of Mar. Syst. (sous presse).
Redfield, A. C.,1958. The biological control of chemical factors in the
environment. Am. Sci. 46 : 205-222.
Ressom, R., Soong, F.S., Fitzgerald, J., Turczynowicz, L., El Saadi, O., Roder,
D., Maynard, T. & Falconer, I., 1994. Health Effects of Toxic Cyanobacteria
(Blue-Green algae). Australian National Health And Medical Research Council,
Looking Glass Press, 108 p.
Ripl, W., 1976. Biochemical oxidation of polluted lake sediment with nitrate. A
new restoration method. Ambio, 5, 132-135.
Ripl, W., 1981. Lake restoration methods developed and used in Sweden.
Restoration of lakes and inland waters. EPA 440.5-81-010, 495-500.
Robin, J.,1999. Dynamique saisonnière du phytoplancton en étang de pisciculture
de la plaine du Forez (Loire). Essai de contrôle des cyanobactéries. Thèse de
l'Université Claude Bernard Lyon I - ISARA Lyon : 213 p.
Rouse, J.D., Bishop, C.A. & Struger, J., 1999. Nitrogen pollution : an
assessmentof its threat to amphibian survival. Environ. Health Perspect.
107 : 799-803.
SCOPE, 1992. Les implications sur l'environnement des phosphates et des
composants chimiques utilisés dans les détergents sans phosphates. SCOPE
International Media Forum, Copenhague, 28/02/1992, Dossier de presse (Annexes),
Annexe IV, 14-18.
Shapiro, J., 1988. Introductory lecture at the international symposium "
Phosphorus in Freshwater Ecosystems ", Uppsala, Sweden, October 1985.
Hydrobiologia, 170 : 9-17.
Skjoldal, H.R. & Dundas, I., 1989. The Chrysochromulina polylepis bloom
in the Skagerrak and the Kattegat in May-June 1988 : environmental conditions,
possible causes, and effects. Report ICES Workshop, Bergen (Norvège) :61 p.
Smith, S.V., 1984. Phosphorus versus nitrogen limitation in the marine
environment. Limnol. Oceanogr.,29(6) : 1149-1160.
Smith, V.H., 1998. Cultural eutrophication of inland, estuarine, and coastal
waters. In : Pace, M.L. & Groffman, P.M. (eds), Successes, Limitations, and
Frontiers in Ecosystem Science. Springer, New York : 7-49.
Stumm, W. & Morgan, J.J., 1970. Aquatic Chemistry, Wiley-Interscience, New York
: 583 p.
Teixera, M.G.L.C., Costa, M.C.N., Carvalho, V.L.P., Pereira, M.S. & Hage, E.,
1993. Bulletin of the Pan American Health Organization, 27: 244-253.
Thomas, E.A., 1962. The eutrophication of lakes and rivers, cause and
prévention. The artificial eutrophication of our waters. Biolog. Problems in
Water Pollution. Third Seminar, August 13-17, 1962, US Dept. of Health, Educ.
and Welfare, 299-305.
Vallentyne, J.R., 1974. The algal bowl. Lakes and man. Environnement
Canada, Service des Pêches et des Sciences de la Mer, Miscellaneous Special
Publication 22, 186 p.
Vollenweider, R.A., 1968. Les bases scientifiques de l'eutrophisation des lacs
et des eaux courantes sous l'aspect particulier du phosphore et de l'azote comme
facteurs d'eutrophisation. OCDE, Paris, Rapport technique DAS/CSI/68.27, 250 p.
WHO, 1996. Guidelines for drinking-water quality. 2nd edition, Vol.
2, Health criteria and other supporting information, WHO Geneva, 313-324.
Yu, S.Z., 1989. Drinking water and primary liver cancer. In : Tang, Z.Y.,
Wu, M.C., & Xia, S.S. (eds) Primary Liver Cancer. China Academic
Publishers, New York, 30-37
Yu, S.Z., 1995. Primary prevention of hepatocellular carcinoma. J.
Gastroenterol. Hepatol., 10(6) : 674-82.
Zevenboom, W. & Mur L.R., 1980. N2-fixing cyanobacteria : why they do not become
dominant in dutch hypertrophic lakes. In : Barica, J. & Mur, L.R., (eds),
Hypertrophic ecosystems. S.I.L. Workshop on hypertrophic ecosystems.
Developments in Hydrobiol., 2 : 123-130.
Zevenboom, W., De Vries, I., Orth, R., Vransen, R. & van Doorn, J.P., 1998.
Nutrients in the sea in relation to nuisance and productivity. Effects of
Nitrogen in the Aquatic Environment. The Royal Swedish Academy of Sciences. KVA
report : 39-62.